«Наверное, главная новость года. В Nature Medicine вышла публикация международной группы врачей: впервые в истории слепой пациент прозрел после инъекции в глаз вируса с генами другого организма», – написал в своем телеграм-канале «Голый землекоп» известный российский биолог и научный журналист Илья Колмановский.
Но по порядку. Сначала давайте поймем, что это все значит.
Пигментный ретинит
Это тяжелое дегенеративное заболевание глаз, которое вызывает сильное ухудшение зрения и очень часто слепоту. У всех людей оно развивается по-разному: у одних дебют происходит в детстве, у других – в юности, причем, чем позднее начало, тем быстрее болезнь прогрессирует.
При пигментном ретините происходит дистрофия сетчатки глаза, вызванная аномалиями фоторецепторов (палочек и колбочек).
Представьте экран телевизора или компьютера. Светящиеся пиксели, формирующие изображение на экране, можно приравнять к миллионам световых рецепторов на сетчатке глаза. Чем меньше пикселей на экране, тем менее отчетливо изображение.
Пигментный ретинит разрушает световые рецепторы, и это разрушение невозможно остановить.
И тут на помощь приходит оптогенетика, о которой тоже нужно сказать несколько слов.
Водоросли-помощники
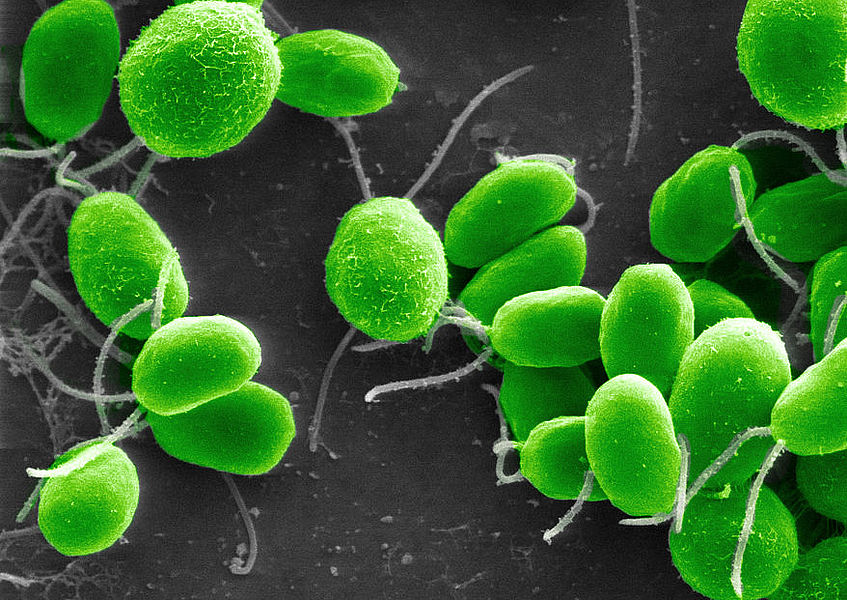
До недавнего времени оптогенетика была лишь методом исследования, хотя и чрезвычайно наукоемким и хитрым.
Дело в том, что фоторецепторы имеются не только на сетчатке человека, но и у других организмов. У одноклеточной водоросли хламидомонады (Chlamydomonas reinhardtii) есть белок ченнелродопсин-2 (ChR2), который является родственником белка родопсина, одного из видов фоторецепторов человеческой сетчатки.
Как и наш родной родопсин, белок водоросли реагирует на облучение светом.
В 2005 году нейрофизиолог Карл Дайссерот, руководивший лабораторией в Стэнфордском университете, решил попробовать внедрить фоторецептор водоросли в электрически возбудимую клетку, то есть в нейрон.
При помощи белка, активируемого светом, очень удобно исследовать функционирование нервных клеток. Так родилась оптогенетика.
Но если можно внедрить ченнелродопсин-2 в нервную клетку, то нельзя ли встроить его в сетчатку человеческого глаза, заменить им утраченный в результате пигментного ретинита родопсин и восстановить зрение?
Этим вопросом задалась группа ученых из ряда европейских и американских научных центров под руководством доктора наук Ботонда Роски.
Эксперименты на мышах, а далее – на приматах оказались обнадеживающими, и в 2019 году исследователи рискнули попытаться восстановить зрение троих взрослых мужчин, ослепших в результате пигментного ретинита.
Впрочем, риск был оправдан: все трое участников эксперимента ничего не видели, и ухудшить состояние их сетчатки было практически невозможно.
Вектор, фоторецепторы и очки
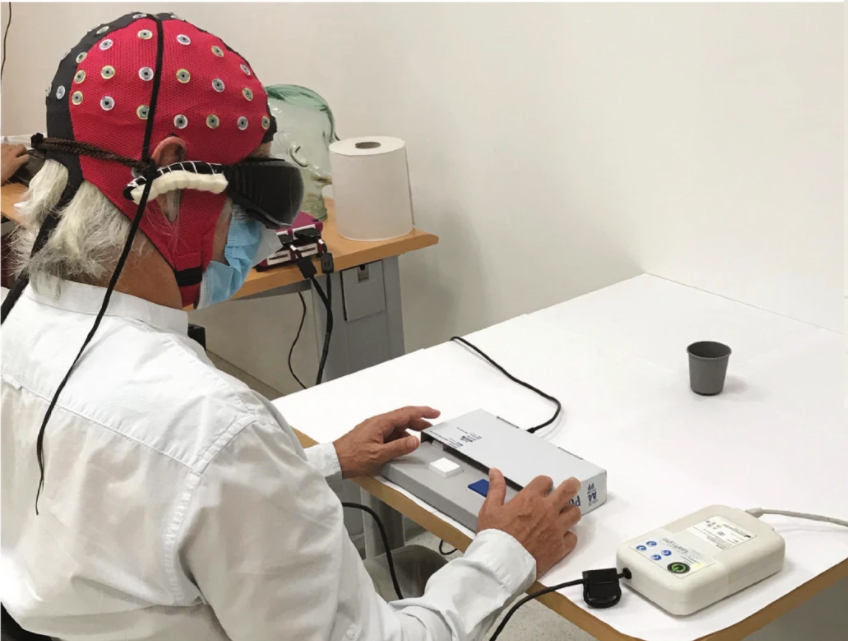
Всем троим мужчинам сделали укол в глаз. Разумеется, если бы им ввели белок сам по себе, то никакого эффекта не было бы. Необходимо доставить в сетчатку ген ChR2, для чего использовали аденоассоциированный вирус, способный проникать в клетку.
Малый вирус, инфицирующий клетки человека и некоторых приматов, но, как считается на сегодняшний день, он не вызывает заболевания у человека. Вирус может встраивать свой геном в геном хозяина. Эти особенности делают его особенно привлекательным кандидатом на роль вирусного вектора для генной терапии.
Нашим читателям наверняка знакома эта технология. За последние полтора года все мы стали немного разбираться в вирусологии и биотехнологиях, мы знаем, что вакцина «Спутник V» устроена именно так: вирус (правда, другой) доставляет в клетку генетический код S-белка коронавируса.
Как и в случае с вакциной, у вируса-вектора был удален ген, ответственный за репликацию, так что функцию доставщика он выполнил, но сам размножаться не стал.
Но и этого оказалось недостаточно.
Белок ChR2 имеет невысокую светочувствительность, и то лишь в красной части спектра, поэтому он был дополнен геном флуоресцентного белка tdTomato. Этот белок при засвечивании вспыхивает красным и возбуждает соседние клетки с водорослевыми белками.
И тут снова возникает препятствие: томатный белок чувствителен только к свету определенной частоты, так называемому янтарному свету. Чтобы создать его, ученые придумали специальные очки, которые проецируют картинку находящейся перед глазами реальности через миниатюрную видеокамеру, при этом ее процессор конвертирует обычное изображение в янтарное.
Испытуемый сдает экзамены
Из-за пандемии довести эксперимент до конца удалось только с одним из участников, 58-летним мужчиной, ослепшим 40 лет назад.
Правда, все трое через некоторое время после инъекции сообщили о том, что, переходя улицу по зебре, видели свечение белых полос. Отметим, что все участники получили от экспериментаторов хитро устроенные очки.
В отличие от мышей и приматов, люди могут рассказать о своих ощущениях, однако человек – существо внушаемое, а научный эксперимент требует объективизации. Для этого ученые разработали специальную систему тестов.
Еще до инъекции экспериментаторы убедились в том, что очки сами по себе не влияли на зрение или восприятие света пациентом. После инъекции прошло четыре с половиной месяца (это время было необходимо для того, чтобы введенные гены успели произвести необходимые белки), и пациент начал посещать лабораторию для тренировки зрения в очках.
Через семь месяцев ученые провели новую серию тестов.
Сначала они по очереди располагали предметы разного размера на расстоянии 60 см от пролеченного глаза пациента. Они были большие (тетрадка размером 12,5 на 17,5 см кв.) – и маленькие (коробочка со скрепками 3 на 5,5 см кв.).
Без очков мужчина не смог увидеть предметы, а надев очки, он не только разглядел их очертания, но и смог по команде экспериментаторов дотронуться до определенного предмета. С большим успехом он проделывал это в отношении более крупных предметов.
Следующий тест заключался в распознавании, определении местоположения и подсчете предметов. Перед испытуемым попеременно ставили два или три стакана и просили подсчитать их, указывая на них пальцем. Экспериментаторы меняли контрастность изображения при помощи цвета стола. Наилучшие результаты пациент продемонстрировал при самой высокой контрастности.
Мозг тоже включился
Конечно, то, чего достиг участник исследования, далеко от полноценного зрения, однако это огромный прорыв, открывающий серьезные перспективы, что подтверждается еще одним тестом.
Во время выполнения заданий испытуемым, исследователи наблюдали за активностью коры его мозга при помощи экстракраниальной мультиканальной электроэнцефалографии.
Они увидели активность в зрительной зоне коры – и это, пожалуй, самая важная хорошая новость, потому что зрение – это не только глаза, но и соответствующие нейронные сети, и, как оказалось, их удалось «включить».
Прежде чем внедрять революционный метод в клиническую практику, необходимо опробовать его на большем количестве добровольцев. Кроме того, сам метод наверняка будет совершенствоваться. Иными словами, впереди – большая работа, однако свет в конце тоннеля уже отчетливо виден. И это не метафора.
Источники:
Partial recovery of visual function in a blind patient after optogenetic therapy
In a First, Optogenetics Leads to Partial Recovery of Vision for Blind Patient